《原子的结构》物质构成的奥秘PPT课件3
![]() 0
0
 《原子的结构》物质构成的奥秘PPT课件3
《原子的结构》物质构成的奥秘PPT课件3
在过氧化氢分解制氧气的实验中,过氧化氢____破裂为氢____和氧____ ,该反应的文字表达为:________________。可见,分子很小,但在化学反应中可以____ ,而____在化学变化中不可再分,所以说____________________是化学变化中的最小的粒子。
(提示:填“分子”或“原子”)
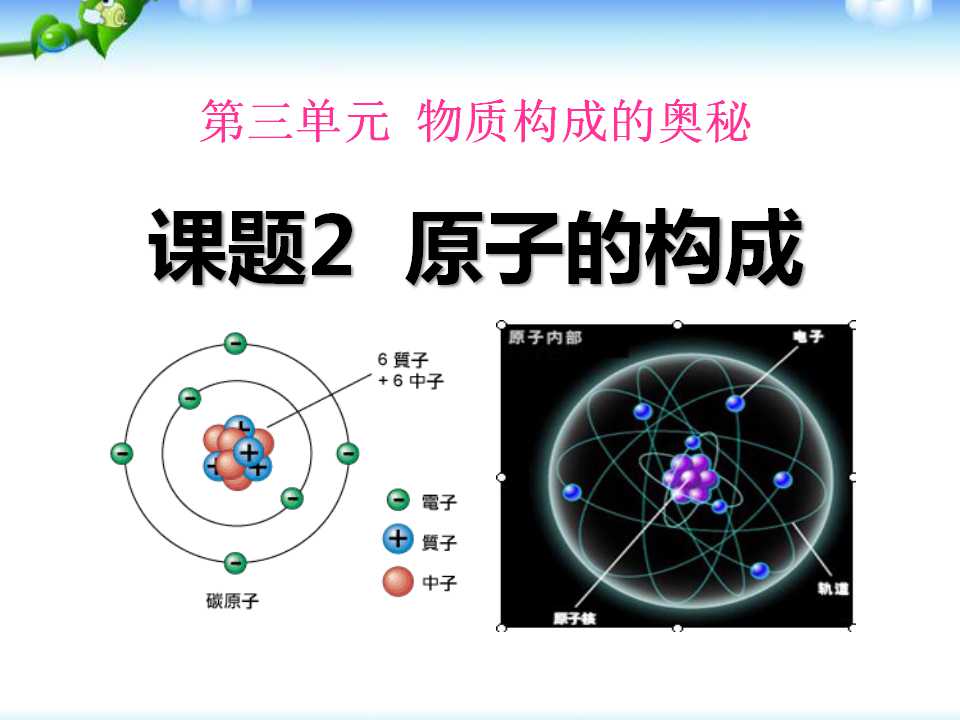
一、原子的构成
1、原子的结构
质 子(带正电)
中 子(不带电)
电 子(带负电)
观察表格(表3-1),思考下列问题
1.不同原子之间有哪些区别?
原子里质子数不同,原子种类也不同。
2.所有原子都是由质子、中子、电子构成的吗?
不是所有的原子都有中子。如氢原子
3. 质子数、中子数在数量上有什么关系?
质子数不一定等于中子数。
4.质子数、电子数、核电荷数、原子序数有什么联系?
质子数=核外电子数=核电荷数=原子序数
... ... ...
1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子____(填显或不显)电性。
2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有____、____、____。
3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子,161个中子,则该元素核外电子数是_____ 。
二 原子核外电子的排布
1、核外电子是分层排布的
2、核外电子分层排布的规律(仅限前3层)
(1)先 “里”后“外” .(能量最低原则)
(2)第一层最多排2个,第二层最多排8个;
(3)最外层最多排8个电子(只有一个电子层时最多 2个电子);
(4)每个电子层最多容纳2n2个电子(n代表电子层数).
... ... ...
⑴在同一周期中,从左到右,原子的电子层数相同(核外电子层数等于周期数),最外层电子数依次增大。
⑵在同一族中,最外层电子数相同但电子层数从上到下依次递增。
⑶同族元素原子的最外层电子数相同,具有相似的化学性质。
①1个H2中含多少个质子和电子?
②1个H3中含多少个质子和电子?
③1个H3+中含多少个质子和电子?
④1个H3O+中含多少个质子和电子?
⑤1个NH4+中含多少个质子和电子?
... ... ...
1.某元素原子最外层上有2个电子,则此元素v w
A:一定是非金属元素 B:一定是金属元素
C:一定是稀有气体元素 D:以上说法都不正确
2.某元素的原子结构示意图为,该元素原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。
3.某粒子的结构示意图如图所示,则m=_____,n=_____,x=_____。该粒子是_____(填粒子的化学符号)
4.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是______;若该粒子带2个单位正电荷,它的化学符号是______;若该粒子不显电性,它的化学符号是______。
《原子的结构》物质构成的奥秘PPT课件6 复习提问 1.分子和原子的定义? 2.分子和原子的特征? 3.化学反应的实质? 在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不..
《原子的结构》物质构成的奥秘PPT课件5 学习目标 1、了解原子的结构,知道原子的微观构成。 2、了解原子核外电子的排布,知道离子的形成过程。 3、知道相对原子质量的概念和计算公式..
《原子的结构》物质构成的奥秘PPT课件4 观察表格(表4-2),思考下列问题 1、不同种原子之间有哪些区别? 不同原子的质子数、中子、电子数都不同。 2、所有原子都是由质子、中子、电..













 关于我们
关于我们 备案号:冀ICP备18037400号-20
备案号:冀ICP备18037400号-20