《原子的结构》物质构成的奥秘PPT课件4
![]() 0
0
 《原子的结构》物质构成的奥秘PPT课件4
《原子的结构》物质构成的奥秘PPT课件4
观察表格(表4-2),思考下列问题
1、不同种原子之间有哪些区别?
不同原子的质子数、中子、电子数都不同。
2、所有原子都是由质子、中子、电子构成的吗?
氢原子的中子数为0,因此,不是所有的原子都有中子。
3、质子、中子、电子在数量上有什么关系?
质子数一定等于电子数,但不一定等于中子数。
4、原子本身带电吗?为什么?
质子和电子数目相等、电性相反,互相抵消 ,所以原子不带电。
... ... ...
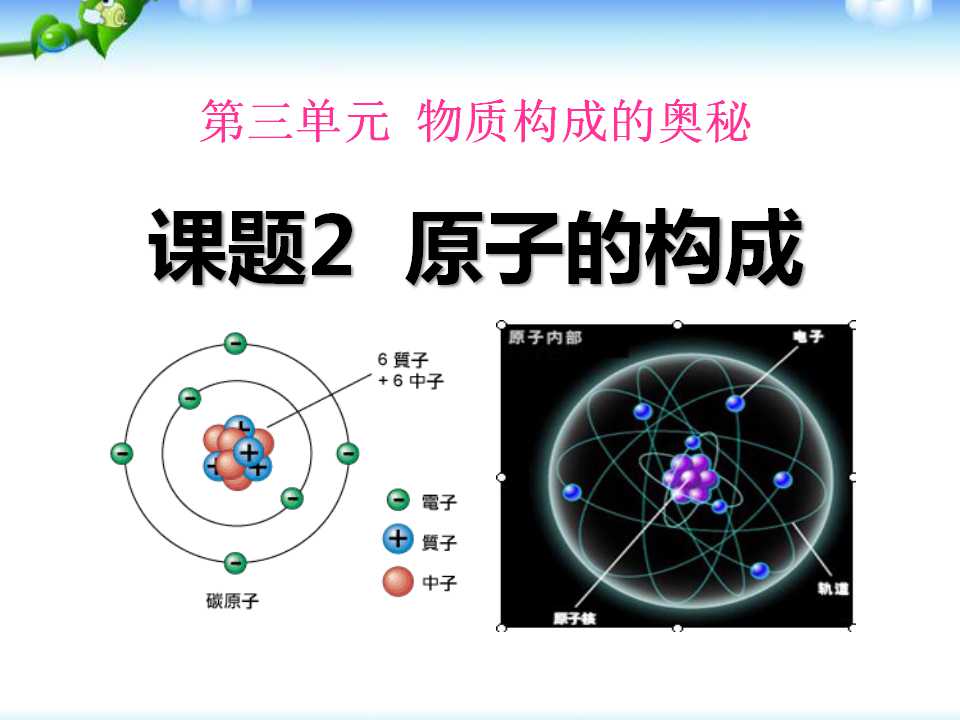
一、原子的构成
质子(带正电)
中子(不带电)
核外电子(带负电)
核电荷数=质子数=核外电子数=原子序数
二、原子核外电子排布
电子在核外的空间里作高速的运动。它们会相互碰撞打架吗? 电子在核外的排布有什么特点?
... ... ...
一、核外电子的排布
特点 1:电子在核外是分层排布的,按照能量由低到高,由里到外分层排布。
能否用一个更简明的图形来表示原子的结构及原子核外电子的排布特点呢?
原子结构示意图
核外电子排布规律:
1.每层最多容纳2n2个电子。
2.最外层不超过8个电子,次外层不超过18个电子。
... ... ...
科学小资料
物质都有趋向于稳定状态的特点(如:水往低处流,树上的苹果往下掉等现象)。
原子也不例外,同样也有趋向于稳定结构的特点。那么,什么样的结构才是原子的稳定结构呢?
稳定结构:像稀有气体元素原子这样的结构叫 8电子稳定结构。若只有一个电子层,则 2 电子也是稳定结构(如: He)。
元素的化学性质主要由最外层电子数决定。最外层电子数相同化学性质也相似。
三、离子的形成
1. 离子的概念:带电荷的原子(或原子团)。
2. 阴离子:带负电荷的原子(或原子团),如: O2-、S2-、 F- 、Cl-。
阳离子:带正电荷的原子(或原子团),如: H+、Na+、Mg2+ 、Al3+。
3. 离子符号的书写:电荷数标注在元素符号的右上角(先写数字后写“+”“-”号)。
... ... ...
1. 填写下列空白
下图是某元素的原子结构示意图,该原子的核电荷数为______,核外有_______个电子层,第二层上有_______个电子,最外层上有______个电子,在化学反应中这种原子容易_______电子。
2. 美国铱星公司(已破产)原计划发射 77 颗卫星,以实现全球卫星通讯,其要发射卫星的数目恰好与铱元素(Ir)的原子核外电子数目相等。下列关于铱元素的各种说法中,正确的是( )。
A. 铱原子的质子数为 70
B. 铱原子的相对质量为 77
C. 铱原子的核电荷数为 77
D. 铱元素为非金属元素
... ... ...
原子的质量测定值
一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克
原子的质量很小,书写、使用都很不方便,怎么办?
... ... ...
已知铁、铝、锌、铜的相对原子质量依次为:56、27、65、64。下列原子各一克,所含原子数最多的是( )
A.铁 B.铝 C.锌 D.铜
1、填表:
2、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16kg
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为____,中子数为____,核外电子数为____。
《原子的结构》物质构成的奥秘PPT课件6 复习提问 1.分子和原子的定义? 2.分子和原子的特征? 3.化学反应的实质? 在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不..
《原子的结构》物质构成的奥秘PPT课件5 学习目标 1、了解原子的结构,知道原子的微观构成。 2、了解原子核外电子的排布,知道离子的形成过程。 3、知道相对原子质量的概念和计算公式..
《原子的结构》物质构成的奥秘PPT课件3 知识回顾 在过氧化氢分解制氧气的实验中过氧化氢____破裂为氢____和氧____ 该反应的文字表达为:________________。可见分子很小但在化学反应中..













 关于我们
关于我们 备案号:冀ICP备18037400号-20
备案号:冀ICP备18037400号-20